ए alkylation एक अणु से दूसरे अणु समूह में स्थानांतरण का संकेत देता है। अल्काइलेशन में एक उत्परिवर्तजन और कार्सिनोजेनिक प्रभाव होता है, क्योंकि डीएनए और आरएनए को अक्सर अल्काइलेटिंग एजेंटों द्वारा हमला और बदल दिया जाता है। तथाकथित एल्केलेटिंग एजेंटों का उपयोग दवा में किया जाता है, एक तरफ कोशिका विकास को साइटोस्टैटिक्स के रूप में बाधित करने के लिए और दूसरी ओर, वे कैंसर को ट्रिगर करते हैं या संतानों में आनुवंशिक क्षति का कारण बनते हैं।
क्षारीकरण क्या है?

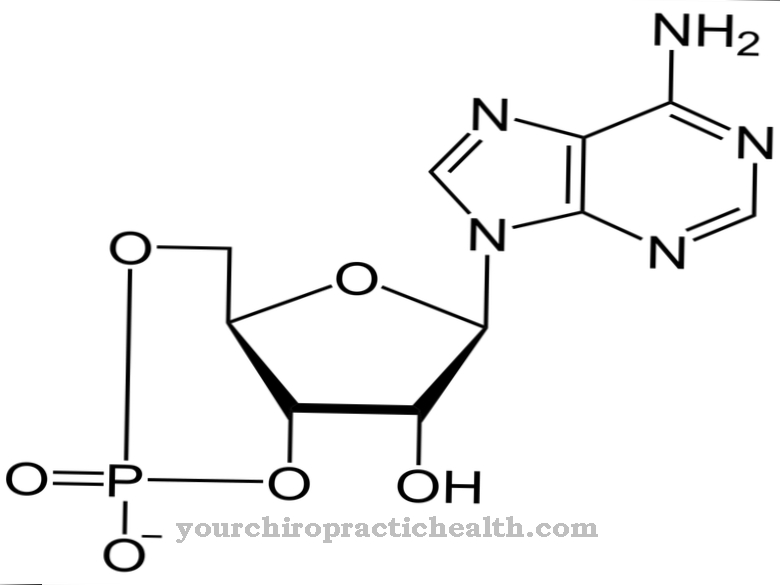
कुछ रासायनिक पदार्थ अल्केलाइजेशन पैदा करने की क्षमता के कारण उत्परिवर्तजन और कार्सिनोजेनिक प्रभाव विकसित करते हैं। अल्काइलेशन के दौरान, अल्काइल समूहों को स्थानांतरित किया जाता है। मिथाइलेशन अल्काइलेशन का एक विशेष मामला है। मिथाइल समूह भी एल्केलीन समूह से संबंधित है। हालांकि, शरीरिक स्थितियों के तहत शरीर में मिथाइलेशन हमेशा होता रहता है, जबकि एक से अधिक कार्बन परमाणु वाले एल्काइल समूह ज्यादातर बहिर्जात पदार्थों के कारण होते हैं।
डीएनए मेथिलिकेशन एपिजेनेटिक परिवर्तनों के लिए जिम्मेदार है। जीव में कई अन्य मेथिलिकरण प्रतिक्रियाएं भी होती हैं। प्रक्रिया में, मिथाइल समूहों को विशिष्ट कार्यात्मक समूहों जैसे कि हाइड्रॉक्सिल, अमीनो या सल्फहाइड्रील समूहों में स्थानांतरित किया जाता है।
जब एथिल, प्रोपाइल या यहां तक कि उच्च-श्रृंखला एल्काइल समूहों को स्थानांतरित किया जाता है, तो आनुवंशिक सामग्री विशेष रूप से खराब होती है। जितने अधिक एल्काइल समूह डीएनए से जुड़ते हैं, उतने ही अधिक बार डीएनए स्ट्रैंड टूटते हैं। इसके अलावा, विभिन्न किस्में भी एक दूसरे से जुड़ी हो सकती हैं। सब के बाद, उच्च-श्रृंखला क्षार हमेशा न्यूक्लिक एसिड के अणुओं में परिवर्तन का नेतृत्व करते हैं। न्यूक्लिक एसिड परिवर्तनों के परिणामस्वरूप, अन्य चीजों के बीच, सेल विकास बाधित होता है।
कार्य और कार्य
अल्कलाइज़ेशन के विकास-अवरोधक प्रभाव के कारण, कैंसर के खिलाफ लड़ाई में संभव अनुप्रयोग हैं। यद्यपि एल्काइलेटिंग यौगिक कार्सिनोजेनिक हैं, वे मौजूदा कैंसर कोशिकाओं के निर्जन विकास को भी रोक सकते हैं। डीएनए को नष्ट करने से, सेल चक्र के तथाकथित चौकियों पर प्रोलिफेरिंग कोशिकाओं (विभाजित कोशिकाओं) की वृद्धि बाधित होती है। कोशिका धीरे-धीरे मर जाती है। यह कैंसर कोशिकाओं और कोशिकाओं दोनों पर लागू होता है जो शारीरिक परिस्थितियों में मजबूत वृद्धि से गुजरते हैं, जैसे प्रतिरक्षा कोशिकाएं, श्लेष्म झिल्ली कोशिकाएं, बाल जड़ कोशिकाएं और रोगाणु कोशिकाएं।
हर कोशिका में डीएनए में परिवर्तन होते हैं, लेकिन प्रभाव और तीव्रता कोशिकाओं के प्रसार में सबसे बड़ी होती है। कोशिकाएं जो विशेष रूप से जल्दी से विभाजित होती हैं इसलिए सबसे अधिक प्रभावित होती हैं। यह कैंसर कोशिकाओं पर साइटोस्टैटिक्स के चयनात्मक प्रभाव का आधार है। यही कारण है कि कीमोथेरेपी के हिस्से के रूप में कई अल्काइलेटिंग साइटोस्टैटिक्स कैंसर थेरेपी में उपयोग किए जाते हैं।
इन पदार्थों के लंबे समय तक उपयोग के साथ, उनकी हानिकारकता बढ़ जाती है, कुछ हद तक, धीरे-धीरे बढ़ने वाली कोशिकाओं को आनुवंशिक रूप से संशोधित किया जाता है। मिथाइलेशन के विशेष मामले में, डीएनए को काफी हद तक मिथाइल किया जाता है। हालांकि, कोई आनुवंशिक परिवर्तन नहीं है। आधार अनुक्रम बरकरार है। मिथाइल समूह केवल साइटिडीन से बंधे होते हैं। डीएनए के मिथाइलेटेड क्षेत्र निष्क्रिय हैं, जिससे कि आनुवंशिक कोड को अब यहां नहीं पढ़ा जा सकता है। इससे डीएनए में एपिजेनेटिक परिवर्तन होते हैं। तो डीएनए को संशोधित किया जाता है, जिससे आनुवंशिक कोड संरक्षित होता है।
एपिजेनेटिक परिवर्तनों के कारण, शरीर फेनोटाइप के संशोधनों के रूप में भी बदलता है। यह ठीक ऐसी प्रक्रियाएँ हैं जो पर्यावरण के विकास और विशिष्ट गुणों की अभिव्यक्ति पर प्रभाव डालने के लिए जिम्मेदार हैं जो जीनोटाइप द्वारा पूरी तरह से निर्धारित नहीं हैं। अलग-अलग अंगों और ऊतकों में अलग-अलग कोशिकाओं के भेदभाव को एपिजेनेटिक परिवर्तनों के साथ भी करना पड़ता है। विभिन्न सेल प्रकारों में जीन की विभिन्न गतिविधि के कारण भेदभाव होता है।
बीमारियों और बीमारियों
रसायन चिकित्सा का आधार अल्काइलेटिंग पदार्थों के साइटोस्टैटिक प्रभाव पर आधारित है। एक ही समय में, हालांकि, कीमोथेरेपी दवाओं के मजबूत साइड इफेक्ट्स उनके अल्काइलेटिंग प्रभाव के कारण भी होते हैं। ये सक्रिय तत्व कोशिकाओं पर उनके विकास-अवरोधक प्रभाव के कारण कैंसर के खिलाफ अपने चिकित्सीय प्रभाव को विकसित करते हैं। कैंसर कोशिकाएं सबसे तेजी से बढ़ती हैं। यही कारण है कि वे सबसे अधिक प्रभावित होते हैं।
हालांकि, प्रतिरक्षा कोशिकाएं, श्लेष्म झिल्ली कोशिकाएं या रोगाणु कोशिकाएं भी विकास में क्षीण होती हैं। नतीजतन, कीमोथेरेपी के ज्ञात दुष्प्रभाव हैं, जो संक्रमण, मतली, उल्टी, एनीमिया, बालों के झड़ने, शुष्क श्लेष्म झिल्ली और अन्य अप्रिय लक्षणों के लिए संवेदनशीलता में प्रकट होते हैं।
कीमोथेरेपी के लिए महत्वपूर्ण साइटोस्टैटिक एजेंट नाइट्रोजन सरसों के यौगिकों, अल्काइल सल्फोनेट्स, नाइट्रोस्यूरा और पदार्थों के विभिन्न समूहों के डेरिवेटिव हैं। इन सभी में जो आम है वह डीएनए पर एक एल्केलाइजिंग प्रभाव है, जो प्रक्रिया में नष्ट हो जाता है। सभी सक्रिय अवयवों का उपयोग कैंसर चिकित्सा के लिए किया जा सकता है, लेकिन इसके विपरीत दुष्प्रभाव भी हैं। यदि कोई स्वस्थ व्यक्ति इन पदार्थों के संपर्क में आता है, तो उनके कैंसर विकसित होने का खतरा बढ़ जाता है।
इन पदार्थों का अल्पकालिक प्रभाव कोशिका विभाजन और कोशिकाओं को मरने से रोकना है। धीरे-धीरे बढ़ने वाली कोशिकाओं में डीएनए में क्रमिक परिवर्तन भी लंबी अवधि में कैंसर कोशिकाओं में उनके रूपांतरण का कारण बन सकता है।
उद्योग और खाद्य उद्योग में क्षारीय रासायनिक यौगिकों में कार्सिनोजेनिक और म्यूटेजेनिक प्रभाव भी होते हैं। इनमें रासायनिक उद्योग में डाइमिथाइल सल्फेट और खाद्य उद्योग में शीत कीटाणुनाशक डिमेथाइल डाइकार्बोनेट और डायथाइल डाइकार्बोनेट शामिल हैं।
गलत होने पर शरीर की अपनी मेथिलिकेशन बीमारियों को भी जन्म दे सकती हैं। बढ़ी हुई या कम जीन गतिविधि डीएनए के मिथाइलेशन पर आधारित है। हालांकि, जब मेथिलिकरण दोषपूर्ण होता है, तो रोग विकसित होते हैं। उदाहरण के लिए गलत जीन सक्रियण से ट्यूमर हो सकता है। यह सच है जब कोशिका विभाजन के लिए एक नियामक जीन निष्क्रिय है। हालांकि, जीन की सक्रियता जो सामान्य रूप से निष्क्रिय होनी चाहिए, कोशिकाओं के अध: पतन को जन्म दे सकती है। संबंधित स्वस्थ ऊतकों की तुलना में विभिन्न ट्यूमर में विभिन्न मिथाइलेशन पैटर्न पाए गए। इससे कोई फर्क नहीं पड़ता कि मेथिलिकेशन की डिग्री बहुत मजबूत है या बहुत कमजोर है।





.jpg)


.jpg)



.jpg)
